Ether
Die Stoffklasse der Ether besitzt eine Sauerstoffbrücke im Molekül. Die Thioether haben stattdessen eine Schwefelbrücke.
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Was sind Ether?
Ether sind organische Verbindungen. Kennzeichnend für sie ist die Sauerstoffbrücke im Molekül. Einen Ether kann man allgemein wie folgt schreiben.
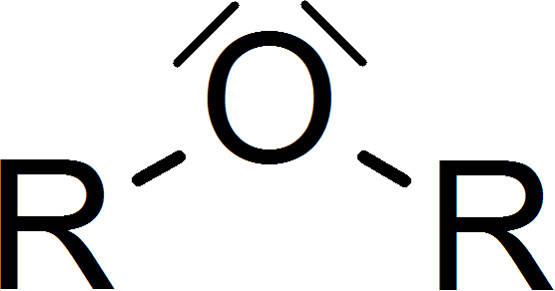
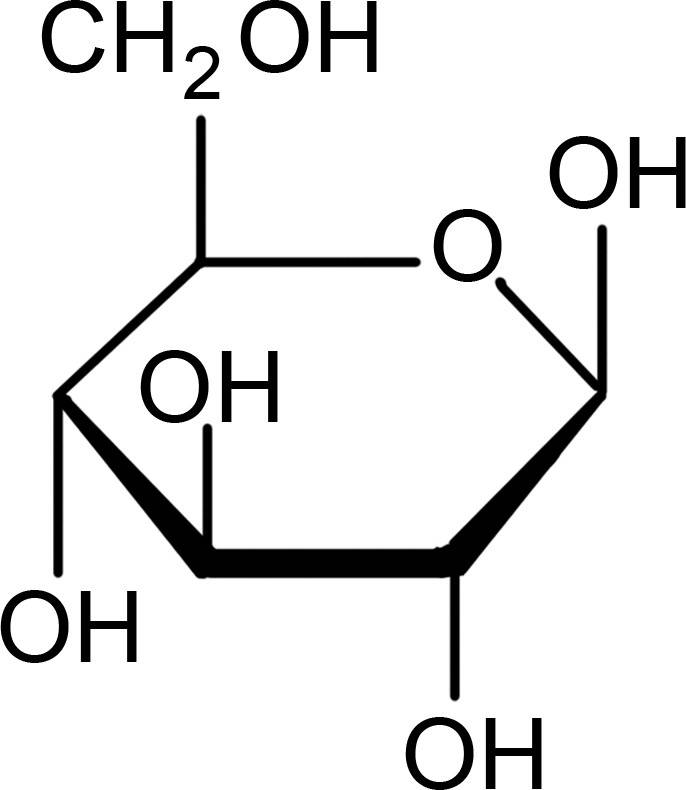
Die Reste an der Sauerstoffbrücke können sowohl aliphatisch als auch aromatisch sein. Durch die freien Elektronenpaare des Sauerstoffs ist das Molekül an dieser Stelle gewinkelt. Ether kommen natürlich in vielen Monosacchariden (Zucker) vor. Glucose liegt zum größten Teil als geschlossener Ring vor und bildet ein Halbacetal. Dieses ist durch eine Sauerstoffbrücke gekennzeichnet. Auch in Polysacchariden liegen Ether-Gruppen in der glycosidischen Bindung vor. Auch Aromastoffe wie das Anillin und Eugenol sind Ether-Verbindungen.
Kurzkettige Ether sind aufgrund der hohen Elektronegativität des Sauerstoffs leicht polar. Da der Sauerstoff aber zwischen organischen Resten liegt, ist der polare Charakter deutlich abgeschwächt. Je länger die Reste werden, desto größer ist der unpolare Charakter des Ethers. Bei cyclischen Ethern liegt der elektronegative Sauerstoff exponierter vor. Dadurch erhält eine solche Verbindung einen ausgeprägten Dipolcharakter. Cyclische Ether sind aus diesem Grund besser wasserlöslich als offenkettige. Verglichen mit Alkoholen vergleichbarer Molmasse besitzen die Ether deutlich niedrigere Schmelz- und Siedepunkte. Das liegt an einer fehlenden Wasserstoffbrückenbindung, da es in Ethern keine sauerstoffgebundenen Wasserstoffatome gibt. Ether sind eher reaktionsträge. Daher eignen sie sich besonders für den Einsatz als organisches Lösemittel in Labor und Industrie.
Ethersynthese
Ether können mithilfe unterschiedlicher Verfahren hergestellt werden. Ein wichtiges Verfahren ist die Williamson-Ethersynthese . Dabei reagiert ein Alkali-Alkoholat mit einem Halogenalkan. Es entstehen ein Alkalihalogenid und der gewünschte Ether. Bei dieser Reaktion handelt es sich um eine nuclephile Substitution. Sie läuft nach dem $S_N~2$-Mechanismus ab. Es entstehen auf diesem Syntheseweg mitunter cyclische Ether wie das Tetrahydrofuran. Ein weiterer Weg der Synthese ist die Kondensation zweier Alkohole. Dies läuft katalysiert durch eine Säure ab. Mithilfe der Ausgangsstoffe kann hier gut die Beschaffenheit der Ether bestimmt werden.
Thioether
Thioether besitzen ein Schwefelatom zwischen zwei organischen Resten. Allgemein können sie durch $R_1-S-R_2$ dargestellt werden. Damit sind die Thioether stark verwandt mit den Ethern. Sie leiten sich wie die Ether auch von den Alkanen ab. Diese werden benannt durch die Anzahl ihrer Kohlenstoffatome. Die Reste können auch hier aliphatisch und aromatisch sein. Wenn eine Verbindung mehrere Schwefelbrücken beinhaltet, spricht man von einem Polythioether. Schwefel besitzt eine deutlich niedrigere Elektronegativität als Sauerstoff. Daher ist der Dipol-Charakter deutlich schwächer als bei den Ethern. Thioether sind aus diesem Grund wasserunlöslich. Außerdem sind die intermolekularen Kräfte dadurch schwächer, was sich an den geringeren Schmelz- und Siedetemperaturen zeigt. Die meisten Thioether sind leichtflüchtige, übelriechende Substanzen. Thioether kommen mitunter bei Aminosäuren vor. Methionin ist ein Beispiel für eine solche Aminosäure. Die Disulfidbrücken sind darüber hinaus sehr wichtig bei der Bildung der Sekundär- und Tertiärstruktur von Proteinen.
Alle Videos und Lerntexte zum Thema
Videos und Lerntexte zum Thema
Ether (6 Videos, 1 Lerntext)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Ether (7 Arbeitsblätter)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Ethansäure
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- fraktionierte Destillation
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung










 Ether – Einführung
Ether – Einführung
 Ether – Einführung (Expertenwissen)
Ether – Einführung (Expertenwissen)
 Ethersynthese
Ethersynthese
 Thiole und Thioether
Thiole und Thioether
 Ether – Synthesen (Expertenwissen)
Ether – Synthesen (Expertenwissen)
 Ether – Reaktionen
Ether – Reaktionen
 Ether – Reaktionen (Expertenwissen)
Ether – Reaktionen (Expertenwissen)









