Stärke und Cellulose
Die Polysaccharide Stärke und Cellulose sind wichtige Biopolymere, die aus Glucose aufgebaut sind. Stärke ist teilweise in heißem Wasser löslich und dient als Verdickungsmittel, während Cellulose in Pflanzen vorkommt und z. B. für Papier verwendet wird. Interessiert? Dies und vieles mehr findest du im folgenden Text.


in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.

Grundlagen zum Thema Stärke und Cellulose
Cellulose und Stärke in der Chemie
Was haben wohl eine Kartoffel und eine Tablette im Medizinschrank gemeinsam? Oder welche Gemeinsamkeit verbindet ein Taschentuch und ein Stück Holz? Sie bestehen zu einem großen Teil aus Stärke bzw. Cellulose. Warum man diese Stoffe auch als Biopolymere bezeichnet und welche Eigenschaften sie haben, wollen wir im Folgenden klären.
Stärke und Cellulose zählen zu den Kohlenhydraten in der Chemie. Es handelt sich um sogenannte Polysaccharide, also Vielfachzucker, die aus Monosacchariden, also Einfachzuckern aufgebaut sind. Die Moleküle der Monosaccharide können sich zu Disacchariden (Zweifachzuckern) oder eben auch zu längeren Molekülketten, den Polysacchariden, verbinden. Polysaccharide wie Stärke und Cellulose sind damit auch Polymere.
Cellulose und Stärke – einfach erklärt
So können wir Cellulose und Stärke schon in ein paar kurzen Sätzen beschreiben:
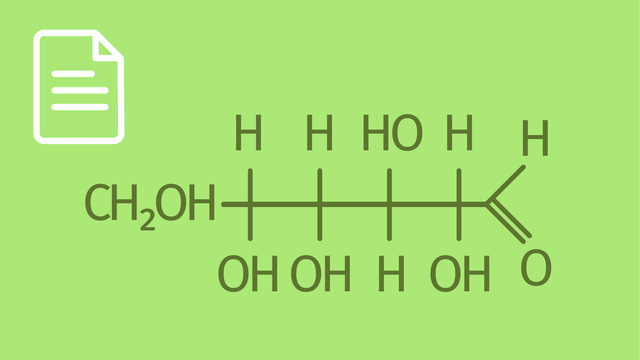
Sowohl bei Stärke als auch bei Cellulose handelt es sich um Polysaccharide (Vielfachzucker) aus der Stoffgruppe der Kohlenhydrate. Sie setzen sich aus mehreren Einheiten von Monosacchariden – hier ist das strukturgebende Monosaccharid die Glucose – zusammen, die über glykosidische Bindungen miteinander verknüpft sind.
Die allgemeine Summenformel für Cellulose und Stärke wird mit $\ce{(C6H10O5)_n}$ angegeben, wobei $n$ die Anzahl der verketteten Glucosemoleküle bezeichnet und in der Regel $n \geq 11$ ist. Analog zu den Kunststoffen (Polymere), die ebenfalls auf langen Kohlenwasserstoffketten aufgebaut sind, bezeichnet man Stärke und Cellulose auch als Biopolymere.
Cellulose und Stärke – Strukturen
Doch was sind die strukturellen Unterschiede zwischen Stärke und Cellulose?
Beide setzen sich aus dem gleichen Monomer zusammen, der
Zu den Strukturer der Cellulose und der Stärke solltest du dir das merken:
Steht die Hydroxygruppe nach unten, spricht man von der
Steht die Hydroxygruppe nach oben, spricht man von der
Abhängig von der Lage der Hydroxygruppe am anomeren Kohlenstoffatom unterscheidet sich auch die Verknüpfung der Glucosemoleküle untereinander. So liegt im Makromolekül der Cellulose eine
Im kettenförmigen Bestandteil der Stärke, der Amylose, sind die
Die Zahlen in den Bezeichnungen der glykosidischen Bindungen sagen aus, welche Kohlenstoffatome Im Sechsring der Glucosebausteine jeweils miteinander verknüpft sind.
Wusstest du schon?
Wenn du Brot toastest, passiert ein kleines chemisches Wunder: Die Stärke im Brot wird teilweise in Zucker umgewandelt, was den leckeren karamellisierten Geschmack erzeugt. Das nächste Mal, wenn du ein Toastbrot genießt, kannst du an diese chemische Verwandlung denken!
Cellulose und Stärke – Eigenschaften
Auch wenn Cellulose und Stärke aus den gleichen Grundbausteinen aufgebaut sind, so führt doch die unterschiedliche Lage der
- geruchloses, weißes, kristallines Pulver (als trockener Reinstoff)
- unlöslich in den meisten organischen Lösungsmitteln
- wasserunlöslich
- Dichte $\rho = \pu{1,5 g//cm3}$
Im Gegensatz zur Cellulose handelt es sich bei Stärke nicht um ein homogenes Biopolymer. Stärke ist im Prinzip ein Gemenge aus den Stoffen Amylose
- geruchloses, weißes, kristallines Pulver (als trockener Reinstoff)
- unlöslich in den meisten organischen Lösungsmitteln
- in kaltem Wasser unlöslich
- in heißem Wasser $\left( \geq \pu{60°C} \right)$ teilweise löslich, Stärke quillt in Wasser zu Stärkekleister
- Dichte $\rho = \pu{1,5 g//cm3}$
Cellulose und Stärke – Abbau und Verwertung
Sowohl Stärke als auch Cellulose können durch spezifische Verdauungsenzyme abgebaut, also zersetzt, werden. Der Mensch besitzt das Enzym Amylase, das im Zuge der Verdauung die Stärke bis zu den einzelnen Glucosemolekülen zersetzt. Cellulose können wir Menschen hingegen nicht enzymatisch verwerten und scheiden diese unverdaut wieder aus. Im Gegensatz dazu können Wiederkäuer wie Kühe Cellulose durch das Enzym Cellulase abbauen. Cellulase wird jedoch nicht von den Wiederkäuern selbst, sondern von Mikroorganismen wie den Wimpertierchen, produziert. Aber auch Pilze und Bakterien können Cellulase produzieren und somit Cellulose spalten.
In der Chemie lassen sich Cellulose und Stärke auch technisch in Anwesenheit von Säuren in ihre Monomere (also Glucose) aufspalten. Den entsprechenden Reaktionsmechanismus bezeichnet man als saure Hydrolyse.
Vorkommen und Anwendung von Cellulose und Stärke
Sicher fallen dir auf Anhieb einige Stoffe ein, die Stärke oder Cellulose enthalten. Im Folgenden sind einige Beispiele für das Vorkommen beider Biopolymere aufgeführt:
Stärke – Vorkommen und Anwendung
Stärke findet man häufig in sogenannten Nutzpflanzen – Pflanzen, die wir für unsere Ernährung oder die Ernährung von Tieren benötigen. Dazu zählen beispielsweise Reis, Mais, Kartoffeln, Weizen und Roggen. Stärke wird aber auch in großen Mengen in der Lebensmittelindustrie verwendet – als Verdickungsmittel in Fertiggerichten, als Zutat in Back- und Süßwaren oder als Grundstoff zur Herstellung von Dextrose, auch als Traubenzucker bzw. Glucose bekannt. Auch in der Pharmazie und Kosmetik findet Stärke Anwendung als Bindemittel, Füllstoff oder Pudergrundlage. Außerdem kann Stärke in Form von Biokunststoff als bioabbaubare Alternative zu Einwegplastik verwendet werden.
Kontrovers diskutiert:
Aktuellen Forschungsergebnissen zufolge könnte die Umwandlung von Stärke in Biokunststoffe eine umweltfreundliche Alternative zu herkömmlichem Plastik bieten. Einige Forschende sind der Meinung, dass dies die Lösung für das Plastikmüllproblem sein könnte, während andere darauf hinweisen, dass der Anbau der benötigten Pflanzen Ressourcen verschwendet und Hektar an Ackerland blockiert. Was denkst du?
Cellulose – Vorkommen und Anwendung
Cellulose bildet den Hauptbestandteil der pflanzlichen Zellwände. Demzufolge ist sie beispielsweise Bestandteil von Holz und Baumwolle und wird als Grundlage für die Herstellung von Jute oder auch von Papier verwendet. Futtercellulose wird in der Ernährung von Tieren eingesetzt, beispielsweise wenn diese an erhöhten Blutzuckerwerten leiden. Der durchsichtige Kunststoff Cellophan ist chemisch modifizierte Cellulose und wird als Verpackungsmaterial eingesetzt.
Kennst du das?
Vielleicht hast du schon einmal erlebt, wie sich neues Papier von recyceltem Papier unterscheidet. Der Unterschied liegt oft in der Menge und Qualität der Cellulosefasern. Neues Papier hat oft stärker bearbeitete Cellulose, während recyceltes Papier kürzere und schwächere Fasern haben kann. Das zeigt, wie wichtig Cellulose für die Papierherstellung ist.
Ausblick – das lernst du nach Stärke und Cellulose
Erweitere deine Kenntnisse über Glucose und Fructose und entdecke die Rolle der Monosaccharide. Die Chemie des Lebens – Kohlenhydrate wird dir mehr über die organische Chemie erklären und dir zeigen, wo überall in uns und um uns herum Chemie steckt. Los geht’s!
Zusammenfassung von Cellulose und Stärke in der Chemie
Wir haben die Polysaccharide Stärke und Cellulose kennengelernt. Ihre Strukturen, ihre Eigenschaften und ihr Vorkommen in der Natur werden in der folgenden Tabelle noch einmal kurz zusammengefasst. Mit dieser Gegenüberstellung hast du die Unterschiede und Gemeinsamkeiten der beiden Biopolymere schnell auf einen Blick parat:
| Stärke | Cellulose | |
|---|---|---|
| Summenformel | $\ce{(C6H10O5)_n}$ | $\ce{(C6H10O5)_n}$ |
| Grundbaustein | $\alpha$-D-Glucose | $\beta$-D-Glucose |
| Art des Polymermoleküls | Amylose unverzweigt; Amylopektin verzweigt | unverzweigt |
| Beispiele für Vorkommen | Kartoffelknolle | Holz, Baumwolle |
| Löslichkeit | teilweise löslich in heißem Wasser | unlöslich in Wasser |
Häufig gestellte Fragen zum Thema Cellulose und Stärke in der Chemie
Transkript Stärke und Cellulose
Guten Tag und herzlich willkommen.
Dieses Video heißt: Stärke und Cellulose. Der Film gehört zur Reihe Kohlenhydrate. Als Vorkenntnisse solltest du über die Begriffe Kohlenhydrate, Monosaccharide, Disaccharide, Polysaccharide und Glucose gut Bescheid wissen. Ziel des Videos ist es, Stärke und Cellulose im Vergleich darzustellen.
Der Film ist wie folgt untergliedert:
- Strukturelle Zuordnung
- Was ist der Unterschied?
- Eigenschaften
- Biologischer Abbau
- Vorkommen
- Verwendung
Nachweis
Strukturelle Zuordnung
Sowohl bei Stärke als auch bei Cellulose, handelt es sich um Biopolymere. Es sind Kohlenhydrate. Als Polymere sind sie Polysaccharide, das bedeutet, es handelt sich um Vielfachzucker. Ihr Baustein ist jeweils die Glucose.
- Was ist der Unterschied zwischen Stärke und Cellulose?
Hier seht ihr ein Modell der D-Glucose. Von Bedeutung ist dieses Kohlenstoff-Atom, man nennt es das anomere Kohlenstoffatom. Die Hydroxylgruppe, hier kaum zu sehen, unten rechts etwas, zeigt nach unten. Bei dieser Struktur handelt es sich um Alpha-D-Glucose. Alpha-D-Glucose ist der Stärkebaustein. Und noch mal ein Molekül der D-Glucose. Wieder betrachten wir das anomere Kohlenstoffatom, die Hydroxylgruppe zeigt diesmal nach oben. Es ist das Molekül der Beta-D-Glucose.
Schauen wir uns die beiden Anomere Alpha und Beta in Haworth Schreibweise an. Wichtig ist die Stellung der Hydroxygruppe am anomeren Kohlenstoffatom, sie zeigt nach unten. Es ist das Alpha-Anomer. Zeigt die Hydroxygruppe am anomeren Kohlenstoffatom nach oben, so ist es das Beta Anomer. In beiden Fällen handelt es sich um Glucose. Aus Alpha-D-Glucose wird Stärke gebildet. Beta-D-Glucose ist der Baustein des Cellulosemoleküls.
Es gibt noch einen 2. Unterschied. Stärke besteht aus den Stoffen Amylose und Amylopektin. Amylose ist zu 20-30 % enthalten, Amylopektin zu 70-80 %.
Cellulose besteht nur aus unverzweigten Molekülen.
Noch einmal: D-Glucose ist der Baustein sowohl von Stärke als auch von Cellulose. Stärke besteht aus Molekülen von Alpha-D-Glucose. Cellulose ist aus Beta-D-Glucose Molekülen aufgebaut. Stärke besteht aus 2 Stoffen, aus Amylose, mit unverzweigten Ketten und aus Amylopektin, das man kann sagen, eine Tannenbaumstruktur besitzt. Cellulose besteht nur aus unverzweigten Polymermolekülen. 3. Eigenschaften
Betrachten wir einige wichtige Eigenschaften von Stärke und Cellulose. Es handelt sich in jedem Fall um weiße, geruchlose Pulver. Stärke ist etwas löslich in Wasser, 50g/l Wasser, allerdings erst bei 90°C. Cellulose ist nicht löslich in Wasser und in den herkömmlichen organischen Lösungsmitteln. Die Dichten beider Ploysaccharide liegen bei etwa 1,5g/cm3. Hydrolyse sowohl von Stärke als auch von Cellulose führt zu Glucose.
- Biologischer Abbau
Bei Stärke erfolgt durch körpereigene Enzyme des Menschen der Abbau bis hin zur Glucose. Solche Enzyme nennt man Amylase.
Dem Menschen fehlen Enzyme um Cellulose abzubauen, der Abbau geschieht jedoch im Wiederkäuermagen. Das Enzym, die Cellulase, wird jedoch von der Wiederkäuern nicht produziert. Cellulase produzieren Wimperntierchen. Auch Flagellaten können das. Genauso können Pilze und Bakterien Cellulase produzieren.
- Vorkommen
Stärke findet man häufig in Pflanzen, die für die Ernährung vorgesehen sind.
Reis, er enthält 89% Stärke.
Die Kartoffel 82%, Maniok 77%, Gerste 74% Stärke, Weizen 75% Stärke, Roggen 72 % und Mais 71%.
Cellulose findet man vorzugsweise in Holz, Baumwolle, Jute und Flachs. 6. Verwendung
An Stärke werden in Deutschland jährlich etwa 2 Millionen Tonnen verbraucht. Man verwendet sie in der Lebensmittelindustrie und als nachwachsende Rohstoffe. Die Anteile betragen 55% und 45%.
Stärke wird heute hauptsächlich aus Kartoffeln und Getreide gewonnen. In der Nahrungsmittelindustrie verwendet man Stärke hauptsächlich für folgende Dinge: Süßwaren, Backwaren, Milchprodukte, Glucosesirup und zur Herstellung von Dextrose.
Stärke dient zur Erzeugung von Wellpappe und Papier. Weitere Anwendungen sind: Beizen von Baumwolle, Biokunststoff als Verpackung, als Einweggeschirr, als Bindemittel oder als Pudergrundlage und modifiziert als Sprengstoff.
Cellulose verwendet man für die Herstellung von Papier. Sie ist ein wichtiges Futtermittel. Cellulose ist Brennstoff. Celluphan, ist modifizierte Glucose, ein Verpackungsmaterial.
- Nachweis
Stärke wird durch ein klassisches Reagenz nachgewiesen, Iod-Kaliumiodid-Lösung, die Lugolsche Lösung. Mit Stärke entsteht ein violetter Komplex.
Ich danke für die Aufmerksamkeit. Alles Gute, auf Wiedersehen.
Stärke und Cellulose Übung
-
Beschreibe die strukturelle Zuordnung von Stärke und Cellulose.
TippsPolysaccharide sind Mehrfachzucker.
Der Grundbaustein für Cellulose und Stärke ist Glucose.
LösungStärke und Cellulose stellen als nachwachsende Rohstoffe und mit ihren zahlreichen Verwendungsmöglichkeiten wichtige chemische Verbindungen dar. Die beiden Stoffe haben als Grundbaustein (Monomer) das Glucosemolekül. So gehören beide Verbindungen zur organischen Chemie, also der Kohlenstoffchemie.
Da sie natürlich vorkommende Polymerverbindungen sind, werden sie als Biopolymere bezeichnet. Sie setzen sich beide aus dem Einfachzucker Glucose zusammen und sind daher Mehrfachzucker oder auch Polysaccharide. Sie gehören also zu der Klasse der Kohlenhydrate, die uns im Alltag in einer Vielzahl von Speisen begegnen.
-
Bestimme die Vorkommen von Stärke und Cellulose.
TippsViele Lebensmittel auf pflanzlicher Basis enthalten Stärke.
Cellulose ist relativ stabil, sodass es unter anderem in Stoffen für die Kleiderherstellung vorkommt.
LösungCellulose und Stärke sind zwei wichtige Stoffe. Ihre Vorkommen sind trotz ihres relativ identischen chemischen Aufbaus sehr unterschiedlich:
Stärke kann häufig in Lebensmitteln gefunden werden. Hier kann man Reis, Kartoffeln, Gerste, Weizen, Roggen und Mais nennen. Der Mensch nimmt also z.B. durch Brot viel Stärke auf. Stärke gehört zu den Kohlenhydraten und kann im Gegensatz zu Cellulose vom menschlichen Magen verarbeitet werden. Hierfür gibt es ein eigenes Enzym, die sogenannte Amylase. Sie ist dafür verantwortlich, dass die Glykosidbindungen gespalten und abgebaut werden können.
Cellulose dagegen kommt in vielen festen Materialien in der Natur vor. Hier kann man Holz, Jute, Baumwolle und Flachs erwähnen. Cellulose begegnet den Menschen im Alltag also viel in Kleidung und Möbelstücken.
-
Beschreibe den Aufbau der Cellulose.
TippsDie Bindungsreaktion erfolgt analog zur Esterbildung unter Wasserabspaltung.
LösungDie Cellulose ist ein Polysaccharid. Sie ist aus vielen Monomeren aufgebaut. Die Monomere sind alle gleich, es sind D-Glucosemoleküle. Die Ausrichtung der Hydroxygruppe am anomeren Kohlenstoffatom bestimmt, ob es sich um die $\alpha$- oder $\beta$-Form handelt. In der Cellulose liegen alle Glucosemoleküle in der $\beta$-Form vor.
Die Reaktion, die zur Bindung zwischen zwei Monomeren führt, ist eine Kondensationsreaktion. Dabei bildet sich die Bindung unter Abspaltung eines Wassermoleküls aus.
Das Sauerstoffatom, welches im Ring liegt, bildet mit einer benachbarten Hydroxygruppe schwache Wasserstoffbrücken aus.
-
Erkläre den Stärkenachweis an einer Kartoffel.
TippsEine Kartoffel ist ein stärkehaltiger Stoff.
LösungDer Stärkenachweis kann an vielen Dingen aus dem alltäglichen Leben durchgeführt werden. So nimmt man in diesem Beispiel eine Kartoffel, da diese, ähnlich wie Reis, einen hohen Stärkeanteil besitzt.
Im ersten Schritt schneidet man die Kartoffel auf. Zum Nachweis wird eine Iod-Kaliumiodid-Lösung verwendet. Diese dient dazu, dass sich Polyiodid-Anionen $[I_5]^-$ bilden. Nun träufelt man die Lösung auf die Kartoffel. Ein Bestandteil der Stärke ist die Amylose. Diese liegt in einer sogenannten Helixstruktur vor (siehe Abbildung). In diese Helix lagern sich die $[I_5]^-$-Ionen ein und es entsteht ein Charge-Transfer-Komplex. Dieser ist ein Elektronen-Akzeptor-Donator-Komplex, aus welchem die charakteristische dunkelblaue Farbe resultiert.
Allerdings ist dieser Zustand reversibel. Beim Erwärmen verschwindet die Färbung auf Grund von vermehrten Molekülschwingungen. Die benötigte Anordnung kommt hierbei nicht zustande.
-
Beschreibe die Eigenschaften von Stärke und Cellulose.
TippsDie OH-Gruppe am anomeren Kohlenstoffatom der Glucose zeigt bei Stärke nach unten. Bei Cellulose zeigt die OH-Gruppe nach oben.
Die Hydrolyse spaltet die Polymere.
LösungDie beiden Moleküle Cellulose und Stärke bestehen aus D-Glucose. Sie unterscheiden sich allerdings darin, dass Stärke aus $\alpha$-D-Glucose aufgebaut ist und Cellulose aus $\beta$-D-Glucose.
Stärke besteht aus $\alpha$-D-Glucose, da die OH-Gruppe am anomeren Kohlenstoffatom nach unten zeigt. Bei der Cellulose zeigt die OH-Gruppe nach oben, hier liegt also $\beta$-D-Glucose vor. Weiterhin liegt in Stärke eine Mischung aus Amylose und Amylopektin vor, wogegen Cellulose lange, unverzweigte Molekülketten (Polymermoleküle) bildet.
Beide sind geruchslose, farblose Pulver und haben in etwa dieselbe Dichte ($\rho =1,5\frac {g}{cm^3} $). Cellulose ist nicht löslich in Wasser, Stärke nur in erwärmtem Wasser. Wenn man beide Moleküle der Hydrolyse aussetzt, so werden beide in Glucose gespalten.
-
Erkläre, warum Cellulose in Wasser unlöslich ist.
TippsJe länger die Kette, desto höher werden die intermolekularen Kräfte, die überwunden werden müssen.
Zwischen den OH-Gruppen der einzelnen Pyranringe bilden sich Wasserstoffbrückenbindungen.
LösungDie Unlöslichkeit in Wasser der Cellulose und teilweise auch der Stärke lässt sich einfach erläutern:
Je größer die Ketten werden, desto mehr intermolekulare Kräfte (Van-der-Waals) treten auf. Diese müssen jedoch beim Lösen überwunden werden, sodass die sehr langkettige Cellulose sich nicht lösen kann.
Bei der Stärke liegt ein Gemisch kürzerer Amolyseketten vor, die sich entsprechend lösen, wobei jedoch den größere Anteil Amylopektin ausmacht, welches sehr verzweigt vorliegt. Beide Moleküle sind jedoch kein Bestandteil der Cellulose.
Ein weiterer Grund ist die Wasserstoffbrückenbindung zwischen den OH-Gruppen, die in benachbarten Pyranringen vorliegen. Diese zusätzlichen Bindungen führen zu einer fast gitterartigen Vernetzung der einzelnen Celluloseketten. Ein Eindringen von Wassermolekülen ist nicht möglich.

Grundbaustoffe der Nahrung – Kohlenhydrate, Eiweiße und Fette

Monosaccharide

Glucose und Fructose

Glucose – Kette oder Ring?

Monosaccharide mit 3 bis 6 C-Atomen

Monosaccharide – Nomenklatur und Stereochemie

Monosaccharide – Eigenschaften und Reaktionen

Pyranosen und Furanosen

D-Ribopyranose und D-Ribofuranose

Sesselform-Schreibweise der Pyranosen

Halbacetal- und Acetalbildung

Disaccharide

Disaccharide – Besondere Glykoside

Reduzierende und nichtreduzierende Disaccharide

Saccharose und Maltose

Polysaccharide

Polysaccharide – Cellulose, Stärke, Glykogen

Stärke und Cellulose

Nachweis von Kohlenhydraten

Moleküldarstellungen von Kohlenhydraten

Zuckerderivate
Glykoside und glykosidische Bindung

Glykolipide und Glykoproteine

Hyaluronsäure, Heparin, Chitin
9.801
sofaheld-Level
6.600
vorgefertigte
Vokabeln
7.798
Lernvideos
37.170
Übungen
32.606
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Schulstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Ethansäure
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- fraktionierte Destillation
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung


 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen

 Bereit für eine echte Prüfung?
Bereit für eine echte Prüfung?












Das sollte nicht vorkommen. Wir werden uns um die Korrektur kümmern. Vielen Dank für den Hinweis!
Es wäre schön, wenn Sie kenntlich machen würden falls es im Video zu so starkem Flimmern kommt.