Säuren und Basen
Säuren und Basen sind Stoffklassen der Chemie. Mit Indikatoren zeigen sie eine charakteristische Farbreaktion.
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Definitionen von Säuren und Basen
Die erste Definition zu Säuren und Basen entwickelte Ende des 19. Jahrhunderts Arrhenius. Säuren waren für ihn Verbindungen, die in wässriger Lösung in positive Wasserstoffionen und negativ geladene Säurerestionen zerfallen. Eine Base dagegen ist eine Verbindung, die in das negativ geladene Hydroxidion und in ein positiv geladenes Baserestion zerfällt.
Diese Definition hatte allerdings einige Schwächen, weshalb sie von Brönsted 1923 noch einmal präzisiert wurde. Er definierte eine Säure als ein Teilchen, welches Protonen abgeben kann. Säuren sind also Protonendonatoren.
![]()
Basen sind demzufolge Teilchen, die Protonen aufnehmen können, also Protonenakzeptoren. Damit war es Brönsted im Gegensatz zu Arrhenius auch möglich, das basische Verhalten von Ammoniak zu erklären.
![]()
Es gibt allerdings auch Verbindungen, die weder Protonen abgeben noch aufnehmen und trotzdem ein saures oder basisches Verhalten zeigen. Das lässt sich durch das Säure-Base-Konzept von Lewis erklären. Er definiert Säuren als Teilchen mit unvollständig besetzter Elektronenschale. Sie sind also Elektronenakzeptoren. Basen dagegen besitzen ein freies Elektronenpaar und sind somit Elektronendonatoren. Dieses Konzept hilft dir später, auch die Entstehung von Komplexen zu verstehen.

Säuren
Im Alltag findest du häufig saure Lösungen an. In den meisten Früchten sind die sogenannten Fruchtsäuren enthalten. In Milch entsteht Milchsäure, wenn man sie länger stehen lässt. Auch in Haushaltsreinigern sind Säuren vor allem als Kalkreiniger enthalten. Allgemein haben saure Lösungen folgende Eigenschaften.
- Sie leiten den elektrischen Strom.
- Sie färben Universalindikator rot.
- Sie reagieren mit unedlen Metallen wie Zink oder Magnesium.
Zu den bekanntesten Säuren gehören:
- Salzsäure (Salzsäure Steckbrief),
- Salpetersäure,
- Kohlensäure,
- Schwefelsäure und
- Phosphorsäure.
Kohlensäure begegnet dir zum Beispiel in Erfrischungsgetränken. Wird Kohlenstoffdioxid unter Druck in das Getränk gepresst, entsteht Kohlensäure, allerdings nur zu einem sehr geringen Teil, da die Kohlensäure nicht sehr stabil ist. Auch Phosphorsäure ist in Getränken wie Cola enthalten. Die Schwefelsäure ist sehr wichtig für die chemische Industrie und begegnet uns im Alltag in Autobatterien als Batteriesäure.
Entstehung von Säuren
Säuren entstehen durch Reaktion von Nichtmetalloxiden und Wasser.
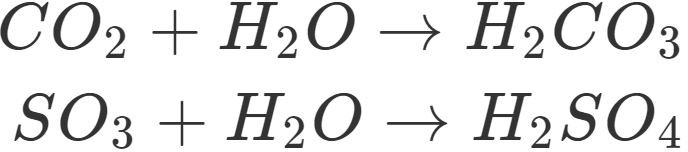
Diese Reaktion findet auch statt, wenn Nichtmetalloxide wie Schwefeldioxid oder Kohlenstoffdioxid als Industrieabgase entstehen und mit der Feuchtigkeit der Atmosphäre reagieren. Die Folge ist saurer Regen. Saurer Regen ist dabei extrem schädlich für die Lebewesen und auch kalksteinhaltige Gebäude werden von ihm angegriffen. Industrieabgase müssen daher gefiltert werden.
Basen
Basen bilden in Wasser alkalische Lösungen. Diese Lösungen werden auch als Laugen bezeichnet. Alkalische Lösungen haben folgende gemeinsame Eigenschaften.
- Sie leiten den elektrischen Strom.
- Sie färben Universalindikator blau.
- Sie lassen die Haut aufquellen und zersetzen organische Stoffe.
Zu den bekanntesten Laugen gehören:
- Natronlauge,
- Kalilauge,
- Kalkwasser und
- Ammoniak.
Kalkwasser wird im Labor als Nachweisreagenz für Kohlenstoffdioxid eingesetzt und die Verwendung von Ammoniak ist unter anderem bei der Herstellung von Reinigungsmitteln geläufig. Natronlauge findest du in sehr verdünnter Form beim Bäcker. Sie wird zur Herstellung von Laugengebäck verwendet.
Entstehung von Laugen
Allgemein entstehen Laugen durch Reaktion von Metalloxiden und Wasser.
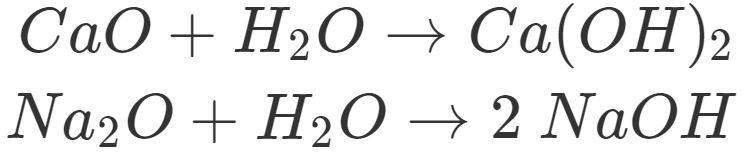
Alle Videos zum Thema
Videos zum Thema
Säuren und Basen (17 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Säuren und Basen (14 Arbeitsblätter)
-
 Säuren und Basen nach Arrhenius
PDF anzeigen
Säuren und Basen nach Arrhenius
PDF anzeigen -
 Die wichtigsten anorganischen Säuren
PDF anzeigen
Die wichtigsten anorganischen Säuren
PDF anzeigen -
 Säuren und Basen nach Brönsted
PDF anzeigen
Säuren und Basen nach Brönsted
PDF anzeigen -
 Säure-Base-Definitionen
PDF anzeigen
Säure-Base-Definitionen
PDF anzeigen -
 Salpetersäure
PDF anzeigen
Salpetersäure
PDF anzeigen -
 Lewis – Säuren und Basen
PDF anzeigen
Lewis – Säuren und Basen
PDF anzeigen -
 Salzsäure
PDF anzeigen
Salzsäure
PDF anzeigen -
 Schwefelsäure
PDF anzeigen
Schwefelsäure
PDF anzeigen -
 Saurer Regen
PDF anzeigen
Saurer Regen
PDF anzeigen -
 Gibt es Kohlensäure wirklich?
PDF anzeigen
Gibt es Kohlensäure wirklich?
PDF anzeigen -
 Basen oder Laugen?
PDF anzeigen
Basen oder Laugen?
PDF anzeigen -
 Natronlauge
PDF anzeigen
Natronlauge
PDF anzeigen -
 Ammoniak
PDF anzeigen
Ammoniak
PDF anzeigen -
 Ammoniaksynthese
PDF anzeigen
Ammoniaksynthese
PDF anzeigen
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Ethansäure
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- fraktionierte Destillation
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung




























