Komplexchemie
Koordinative Bindung, Aufbau von Metallkomplexen, Chelatkomplexe
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
- Aufbau von Metallkomplexen
- Koordinative Bindung
- Nomenklatur von Metallkomplexen
- Chelatkomplexe
- Ligandenfeldtheorie
Aufbau von Metallkomplexen
Metallkomplexe bestehen aus einem Zentralteilchen (Metallkation oder Metallatom) und mehreren Liganden, die räumlich um das Zentralteilchen angeordnet sind.
Das Zentralteilchen ist eine Lewis-Säure, dieses weist eine Elektronenlücke auf und ist damit ein Elektronenpaarakzeptor. Vorzugsweise bilden die Übergangsmetalle (Nebengruppenmetalle) Metallkomplexe. Das liegt daran, dass sich ihre Valenzelektronen in d-Orbitalen aufhalten. Diese bieten aufgrund ihrer Anzahl (5 d-Orbitale) die Möglichkeit, viele Liganden zu koordinieren. Beispiele für Zentralionen sind die Ionen des Eisen $(Fe^{2+},~Fe^{3+})$, Cobalts $(Co^{3+})$ und Nickels $(Ni^{2+})$. Liganden sind Lewis-Basen. Sie tragen freie Elektronenpaare und können diese in einer koordinativen Bindung zur Verfügung stellen. Sie sind Elektronenpaardonatoren. Es gibt anionische Liganden, wie die Halogenidionen, das Hydroxidion und das Cyanidion, sowie neutrale Liganden, wie Wasser und Ammoniak.
Komplexe weisen dabei unterschiedliche Koordinationszahlen (KZ) auf. Die Koordinationszahl gibt an, wie viele Liganden an das Zentralteilchen gebunden sind. Die häufigsten Koordinationszahlen sind 2, 4 und 6. Dabei hat jede Koordinationszahl ihre spezifische räumliche Struktur.
Koordinative Bindung
Die vorherrschende Bindung in Komplexen ist die koordinative Bindung (auch dative Bindung genannt). Diese kommt zwischen einer Lewis-Säure und einer Lewis-Base zustande. Die Base trägt mindestens ein freies Elektronenpaar und die Säure ein freies Orbital (Elektronenvakanz). Durch Überlappung der Orbitale bildet sich ein neues, gemeinsames Orbital. In diesem teilen sich nun Lewis-Säure und -Base das Elektronenpaar. Eine koordinative Bindung ist entstanden. Der Unterschied zu einer kovalenten Bindung besteht darin, dass bei einer koordinativen Bindung ein Partner beide Elektronen einbringt, während bei einer kovalenten Bindung jeder Bindungspartner ein Elektron beisteuert.
Nomenklatur von Metallkomplexen
Wie verhält sich die Nomenklatur bei Komplexen? Um Metallkomplexe zweifelsfrei benennen zu können, ist es notwendig, die Regeln der Nomenklatur zu kennen.
Für Komplexe wird der Name wie folgt gebildet. Zuerst wird die Anzahl der Liganden mit dem griechischen Zahlwort benannt (mono, di, tri, tetra, penta, hexa, …). Dann folgt der Name der Liganden. Anionische Liganden (negativ geladen) erhalten die Endung „o“, z.B. fluorido $(F^-)$, bromido $(Br^-)$ und hydroxido $(OH^-)$. Der Name anderer wichtiger Liganden lautet aqua $(H_2O)$, ammin $(NH_3)$ und carbonyl $(CO)$. Wenn es mehrere Liganden sind, erfolgt die Aufzählung alphabetisch. Dann wird das Zentralteilchen benannt und die Oxidationszahl in Klammern als römische Ziffer dahinter geschrieben.
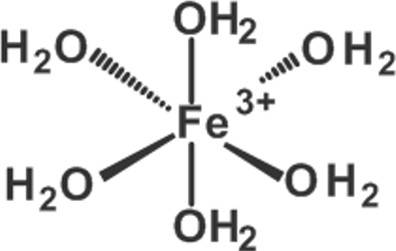
Befolgst du die Regeln der Nomenklatur, erhältst du für den gezeigten Komplex den Namen Hexaaqua-Eisen(III)ion.
Ist ein Komplex negativ geladen, erfolgt die Benennung auf fast die gleiche Weise. Nur das Zentralion wird mit seinem lateinischen Namen und der Endung -at bezeichnet und kleingeschrieben. Der Komplex $[Fe(Br)_6]^{4-}$ heißt dementsprechend Hexabromidoferrat(II)-Ion.
Chelatkomplexe
Chelatkomplexe enthalten Chelatliganden. Dies sind Liganden, die mehrere Donoratome beinhalten. Man spricht hier von Zähnen. Chelatliganden sind also mehrzähnige Liganden. Sie können mehrere koordinative Bindungen mit dem Zentralteilchen eingehen. Aus diesem Grund sind Chelatkomplexe, gegenüber Komplexen mit einzähnigen Liganden, äußerst stabil. Sie werden häufig in der chemischen Industrie und der analytischen Chemie eingesetzt, um zum Beispiel störende Ionen zu binden. Man nennt dies Maskierung. Ein sehr häufig eingesetzter Chelatligand ist EDTA.
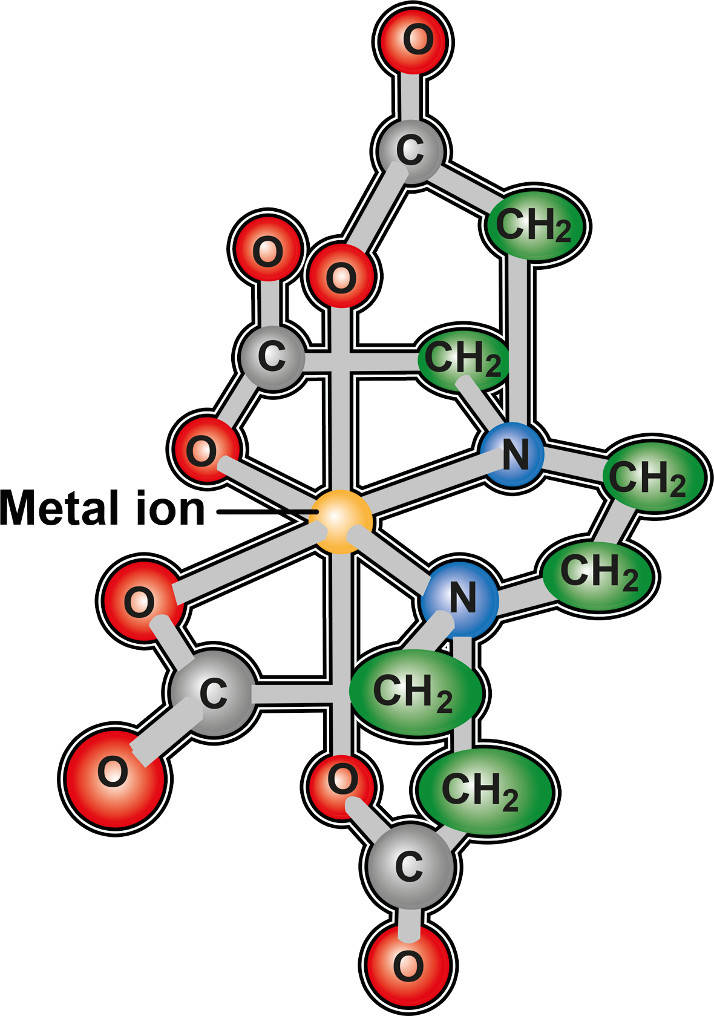
EDTA ist ein 6-zähniger Ligand, der in vielen Bereichen, wie Textilindustrie, Kosmetika und Zahnmedizin, zum Einsatz kommt.
Ligandenfeldtheorie
Mit der Ligandenfeldtheorie kann die Farbigkeit der Metallkomplexe erklärt werden. Die Farbigkeit hängt dabei vom jeweiligen Zentralelement, dessen Ordnungszahl und dem an das Metall gebundenen Liganden ab. Bei der Komplexbildung werden die d-Orbitale des Metallions energetisch angehoben, aber nicht alle gleich stark. Die Orbitale die in Richtung der Liganden orientiert sind, werden stärker angehoben als die anderen Orbitale. Dadurch entsteht ein energetisches Potential zwischen den Orbitalen.
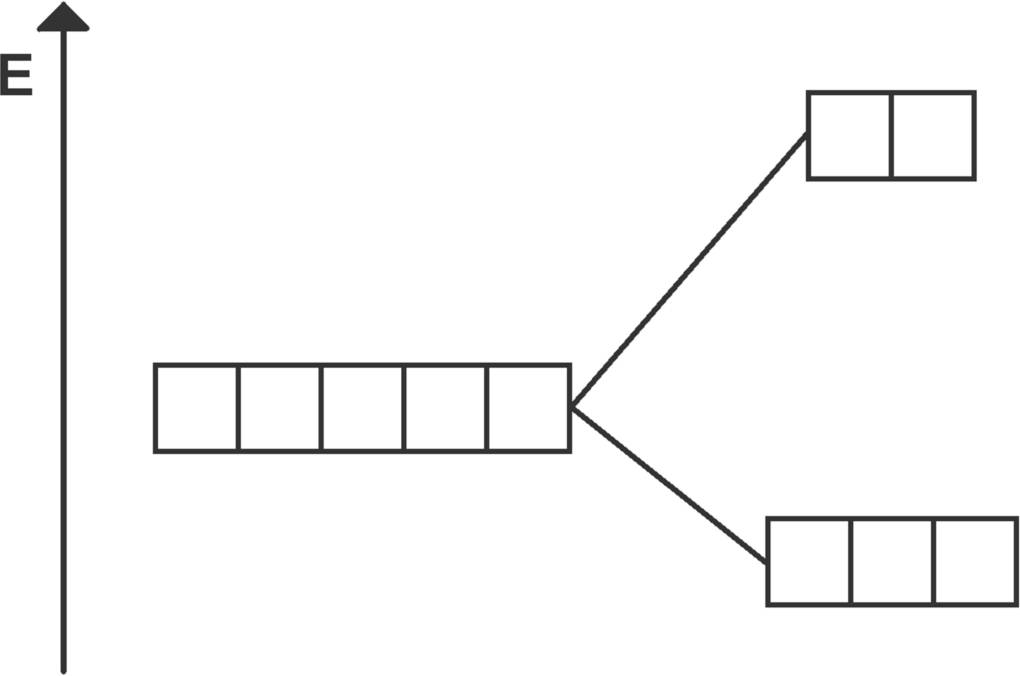
In dieser Energiedifferenz steckt die Farbigkeit der Komplexe. Elektronen, die aus einem besonders stark angehobenen Orbital in das schwächer angehobene springen, senden Photonen aus, deren Wellenlänge genau der charakteristischen Farbe des Komplexes entspricht. Je nach gebundenen Liganden verändert sich das Potential zwischen den Orbitalen.
Alle Videos zum Thema
Videos zum Thema
Komplexchemie (12 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Komplexchemie (12 Arbeitsblätter)
-
 Nomenklatur von Komplexen
PDF anzeigen
Nomenklatur von Komplexen
PDF anzeigen -
 Metallionen und Komplexbildung
PDF anzeigen
Metallionen und Komplexbildung
PDF anzeigen -
 Koordinative Bindung
PDF anzeigen
Koordinative Bindung
PDF anzeigen -
 Aufbau von Metallkomplexen
PDF anzeigen
Aufbau von Metallkomplexen
PDF anzeigen -
 Eigenschaften durch Komplexbindung von Metall-Ionen
PDF anzeigen
Eigenschaften durch Komplexbindung von Metall-Ionen
PDF anzeigen -
 Reaktionen mit Metallkomplexen
PDF anzeigen
Reaktionen mit Metallkomplexen
PDF anzeigen -
 Chelatkomplexe
PDF anzeigen
Chelatkomplexe
PDF anzeigen -
 Bedeutung von Chelatkomplexen
PDF anzeigen
Bedeutung von Chelatkomplexen
PDF anzeigen -
 Chelatkomplexe für Mediziner
PDF anzeigen
Chelatkomplexe für Mediziner
PDF anzeigen -
 Ligandenfeldtheorie – Farbigkeit von Komplexen
PDF anzeigen
Ligandenfeldtheorie – Farbigkeit von Komplexen
PDF anzeigen -
 Ligandenfeldtheorie – Magnetismus von Komplexen
PDF anzeigen
Ligandenfeldtheorie – Magnetismus von Komplexen
PDF anzeigen -
 Hydratisierte Metallionen als Säuren
PDF anzeigen
Hydratisierte Metallionen als Säuren
PDF anzeigen
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Ethansäure
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- fraktionierte Destillation
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung























