Löslichkeit
Die Löslichkeit bestimmt wie viel von einem Stoff man in einem Lösungsmittel, wie Wasser, lösen kann.
Beliebteste Videos und Lerntexte
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Löslichkeit und gesättigte Lösungen
Die Löslichkeit spielt bei dem Betrachten von Lösungen eine wichtige Rolle. Lösungen sind homogene Stoffgemische aus Feststoffen, Flüssigkeiten oder Gasen in einem flüssigen Lösemittel. Homogen bedeutet, dass nur eine Phase vorherrscht und an jedem Punkt der Lösung die gleichen Eigenschaften vorliegen.
Stoffe lösen sich unterschiedlich gut in den verschiedenen Lösemitteln. Das hat oft mit der Polarität der Stoffe zu tun. Allgemein gilt: „Gleiches löst sich in Gleichem“. Ein polarer Stoff, wie ein Salz, wird sich meist gut in dem polaren Lösemittel Wasser lösen lassen. Öl, welches sehr unpolar ist, löst sich in Wasser dagegen überhaupt nicht. Es bilden sich zwei gut unterscheidbare Phasen aus.

Auch wenn sich ein Stoff gut in einem Lösemittel löst, kann es von diesem Stoff nicht unbegrenzt viel aufnehmen. An einem bestimmten Punkt ist die Löslichkeit des Stoffes erreicht. Wird nun weiterhin dieser Stoff zugeführt, fällt er aus. Bei Feststoffen sieht man dies dann an dem gebildeten Bodensatz.
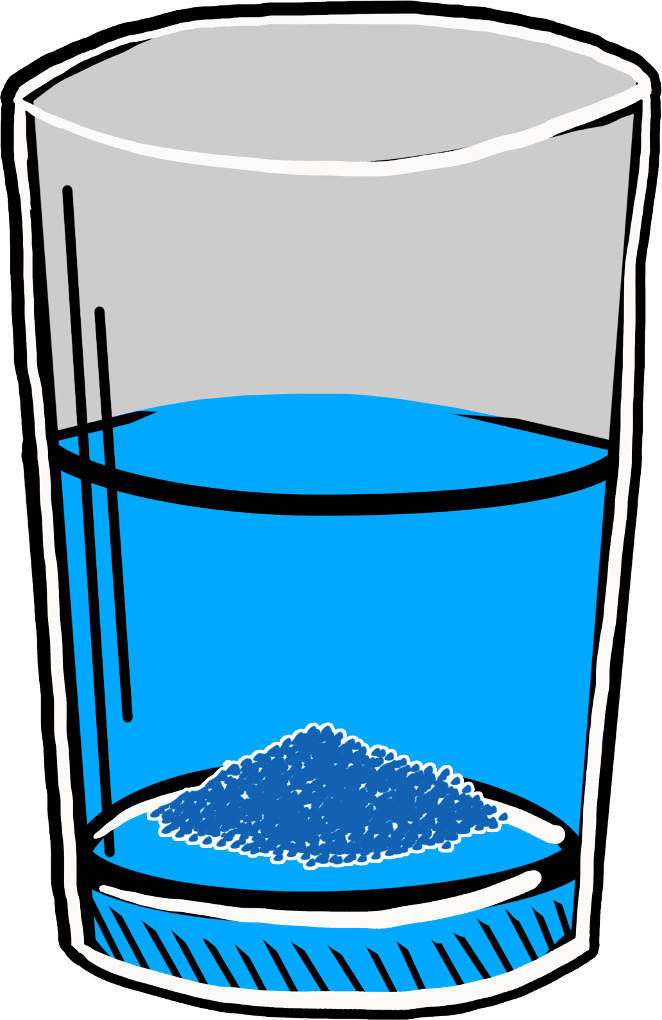
Fällungsreaktionen
Diese Grenze der Löslichkeit nutzt man bei Fällungsreaktionen aus. Im Verlauf dieser Reaktion wird ein schwerlösliches Salz gebildet. Da die Löslichkeit dieses Salzes sehr schnell überschritten wird, fällt es sichtbar als Feststoff aus. Dieser wird als Niederschlag bezeichnet.
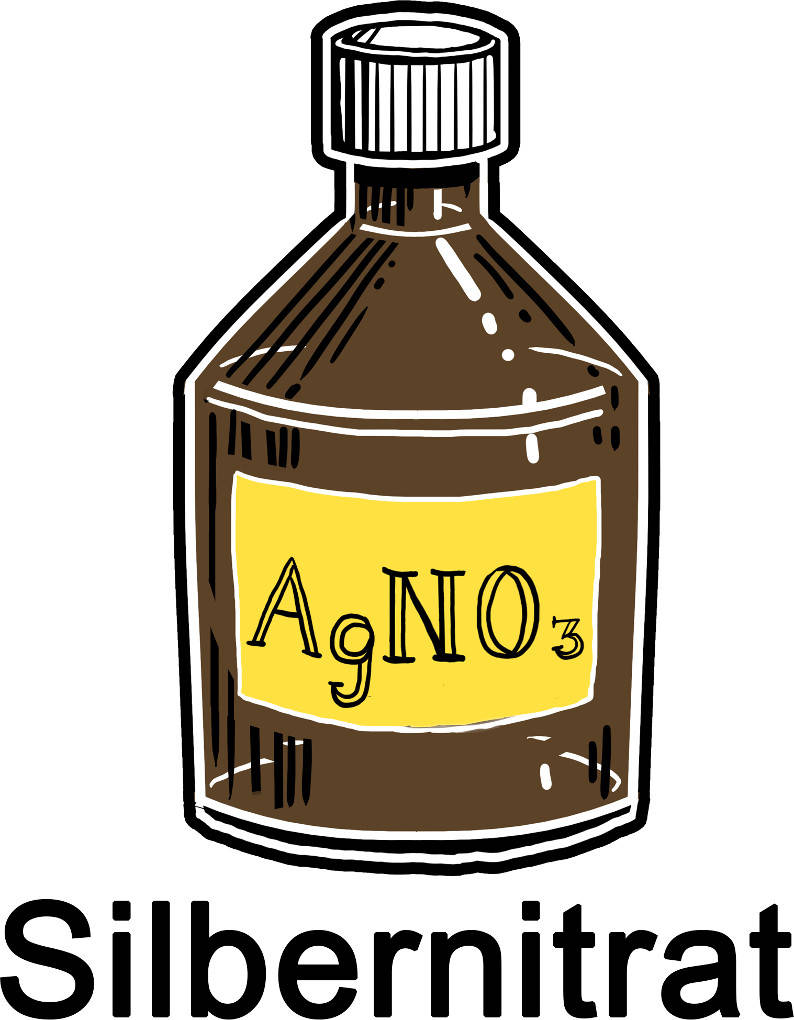
Diese Reaktionsart wird genutzt, um verschiedene Stoffe nachzuweisen. Eine sehr bekannte Nachweisreaktion ist die Reaktion von Silbernitrat mit Halogeniden, wie Chlorid, Bromid und Iodid. Dabei bildet sich ein schwerlösliches Silberhalogenid.
$Ag^+ + X^- \longrightarrow~AgX\downarrow$
Des Weiteren kann man Fällungsreaktionen für Titrationen nutzen. Dies ist eine Methode der analytischen Chemie, bei der Stoffe mengenmäßig bestimmt werden. Man gibt tropfenweise eine bekannte Lösung zur Probe. Sobald kein Niederschlag mehr ausfällt, ist der enthaltene Stoff in der Probe vollständig verbraucht. So kann mit dem Volumen der zugegebenen Lösung der Gehalt des Stoffes in der Probe errechnet werden.
Löslichkeitsprodukt
Das Löslichkeitsprodukt beschreibt das Gleichgewicht, das sich zwischen den gelösten Ionen und dem Bodensatz eines Salzes bildet. Dafür ist die Dissoziationsgleichung besonders wichtig. Aus dieser kann man die Stöchiometrie ablesen. Das heißt, die Reaktionsgleichung zeigt, in wie viele Ionen das Salz dissoziiert (zerfällt). Ein Beispiel ist die Dissoziation von Calciumcarbonat $(CaCO_3)$.
$CaCO_3\rightleftharpoons~Ca^{2+} + {CO_3}^{2-}$
Da es sich um eine Gleichgewichtsreaktion handelt, kann für jede Dissoziation das Massenwirkungsgesetz aufgestellt werden. Dabei handelt es sich um einen mathematischen Ausdruck. Es werden die Konzentrationen der Reaktionsprodukte multipliziert. Dies wird dann durch das Produkt der Konzentrationen der Reaktionsedukte geteilt. Für die Dissoziation von Calciumcarbonat bedeutet das:
$K= \dfrac{c(Ca^{2+})\cdot c({CO_3}^{2-})}{c(CaCO_3)}$.
Der Bodensatz liegt als Feststoff vor. Aus diesem Grund wird dessen Konzentration als konstant angenommen. $c(CaCO_3)$ kann also aus der Gleichung entfernt werden. Das Löslichkeitsprodukt ist daher nur noch das Produkt der Konzentrationen der gelösten Ionen.
$LP= c(Ca^{2+})\cdot c({CO_3}^{2-})$
Mithilfe des Löslichkeitsproduktes ist es dir möglich, die Konzentration der gesättigten Lösung eines Stoffes zu berechnen.
Alle Videos und Lerntexte zum Thema
Videos und Lerntexte zum Thema
Löslichkeit (7 Videos, 2 Lerntexte)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Löslichkeit (7 Arbeitsblätter)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Cellulose Und Stärke Chemie
- Süßwasser Und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel Und Die Dynamit Entdeckung
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Kohlenwasserstoff
- Kovalente Bindungen
- Wasserhärte
- Peptidbindung
- Fermentation
- Nernst-Gleichung, Konzentrationsabhängigkeit Des Elektrodenpotentials
- Ethanol Als Lösungsmittel
- Kohlenstoff














 Lösungen und Löslichkeit
Lösungen und Löslichkeit
 Osmose in Lösungen
Osmose in Lösungen
 Latentwärmespeicher
Latentwärmespeicher
 Fällungsreaktionen
Fällungsreaktionen
 Löslichkeitsprodukt
Löslichkeitsprodukt
 Nernst-Verteilungssatz
Nernst-Verteilungssatz
 Osmose – Einführung
Osmose – Einführung









